Angew. Chem. Int. Ed.丨吴冬冬/白晨团队探索超薄肽基纳米片
2024年5月,四川大学生物医学工程学院吴冬冬教授与晨伫科技白晨团队在Angew. Chem. Int. Ed.上发表了题为“Multi-Responsive Peptide-Based Ultrathin Nanosheets Prepared by a Horizontal Monolayer Assembly”的研究论文。这项研究这项工作不仅刷新了肽基纳米材料的厚度记录,也为2D材料的功能化和智能化提供了新的思路。
材料简介
二维(2D)纳米材料因其独特的物理化学性质和在多个领域的应用前景而备受关注。特别是在生物医学领域,2D材料展现出了作为药物递送系统、生物传感器和组织工程支架的巨大潜力。然而,现有的2D材料往往存在制备复杂、功能单一等问题,限制了它们在实际应用中的效能。为了克服这些限制,研究团队聚焦于肽基材料,利用其生物相容性好、结构可调等特点,通过创新的共价-物理制造策略,成功制备了厚度仅为1纳米的超薄纳米片。
研究测试
在这项研究中,研究团队采用了一种分层共价物理制造策略,制备了厚度约为1纳米的基于肽的自组装纳米片。通过螺旋肽E3与偶氮苯(AZO)结构的共价交替聚合,产生了共聚物CoP(E3–AZO),这些共聚物在物理上自组装成了超薄的纳米片,形成了一个意想不到的二维水平单层排列,这种特殊的单层排列使得纳米片的厚度等同于单个线性共聚物的横截面直径。。通常在自组装纳米片中,自组装分子都是垂直于纳米片片面进行堆积和排列的,纳米片的厚度由自组装分子的长度所决定,至少都是大于2 nm。因此这里报道的自组装聚合物平行于纳米片平面的排列方式则是一个罕见的现象。
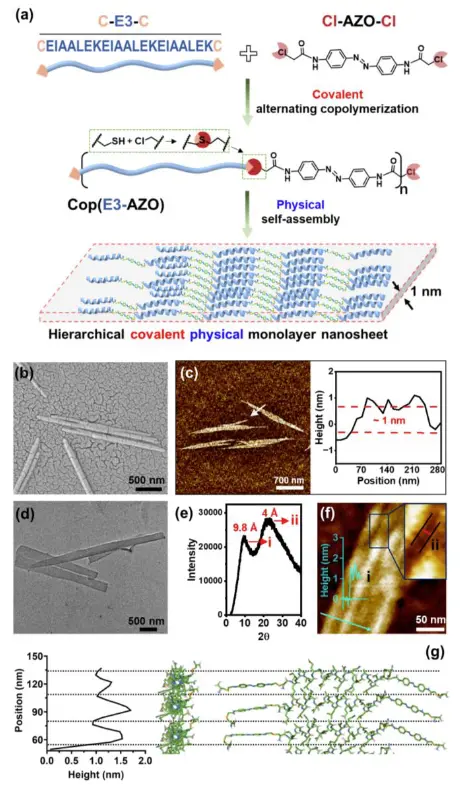
图 1. 超薄纳米片的形成和表征。 (a) 通过共价聚合和物理自组装的分层过程合成二维超薄纳米片的示意图。(b) 超薄纳米片的 SEM 图像。 (c) 超薄纳米片的 AFM 图像和高度剖面。 (d) 超薄纳米片的 TEM 图像。(e) 超薄纳米片粉末样品的 WAXS 光谱。 (f) AFM 图像,指示与 WAXS 图中的两个峰值信号相对应的纳米片中可能的距离。(g) 分子卡通图,说明单个纳米片内的规则高度变化。
接着利用分子动力学模拟发现是多种分子间相互作用的协同效应推动了CoP(E3–AZO)自组装成纳米片。其中分子之间强的静电相互作用导致共聚物聚集, 纳米片的π-π堆积和阴离子表面有利于二维自组装,疏水效应和氢键可以稳定二维聚合物组装。
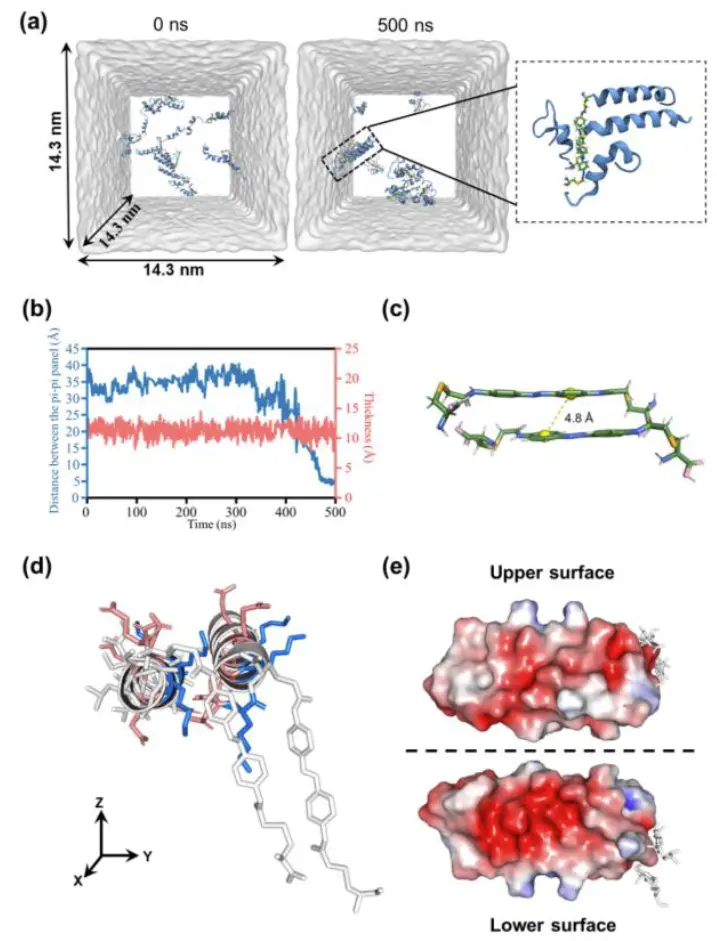
图2.超薄纳米片的分子模拟。 (a) E3与偶氮苯形成的共聚物自组装的分子动力学模拟。 该模型共聚物由两个E3片段和一个偶氮苯结构组成。 模拟显示了模型共聚物在初始状态(0 ns)和最终状态(500 ns)的结构。 (b) π-π 面板之间的距离和聚集模型聚合物的厚度的演变。 (c) 两种模型聚合物(含偶氮苯)的 DFT 优化结构; π-π面板之间的距离为4.8 Å。 (d) 平行聚合物的构型。 带正电的赖氨酸残基显示为蓝色,带负电的谷氨酸残基显示为红色。 (e) 平行聚合物上下表面的静电势。带正电的区域显示为蓝色,带负电的区域显示为红色。
另外,研究团队还发现用不同方法,例如光处理、pH调节、添加剂的加入和共溶剂的引入,可以改变分子相互作用并调节CoP(E3–AZO)的自组装,产生多样化的纳米结构。
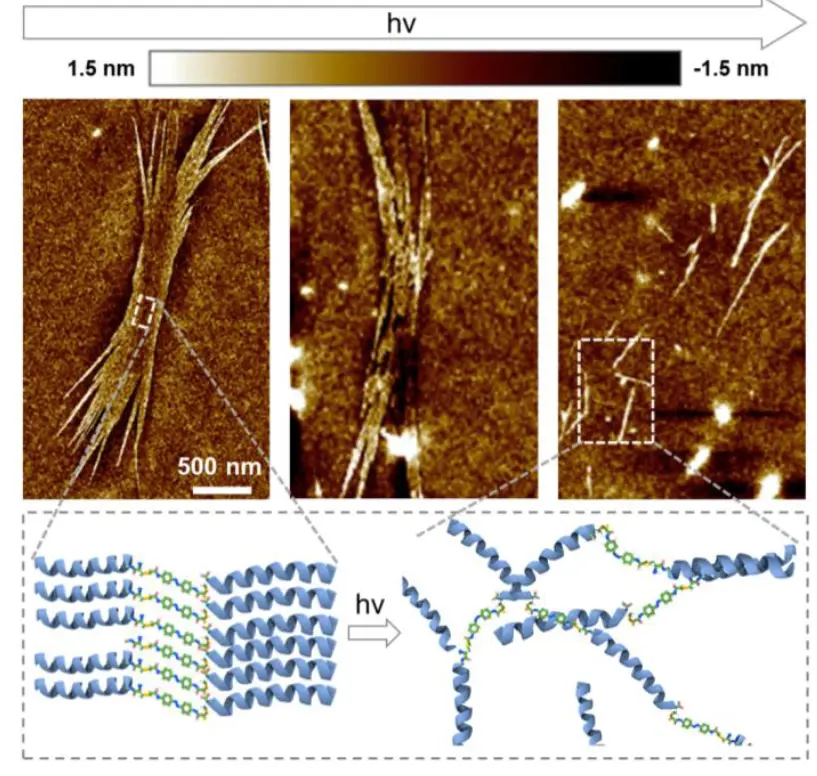
图 3. 超薄纳米片的光响应。
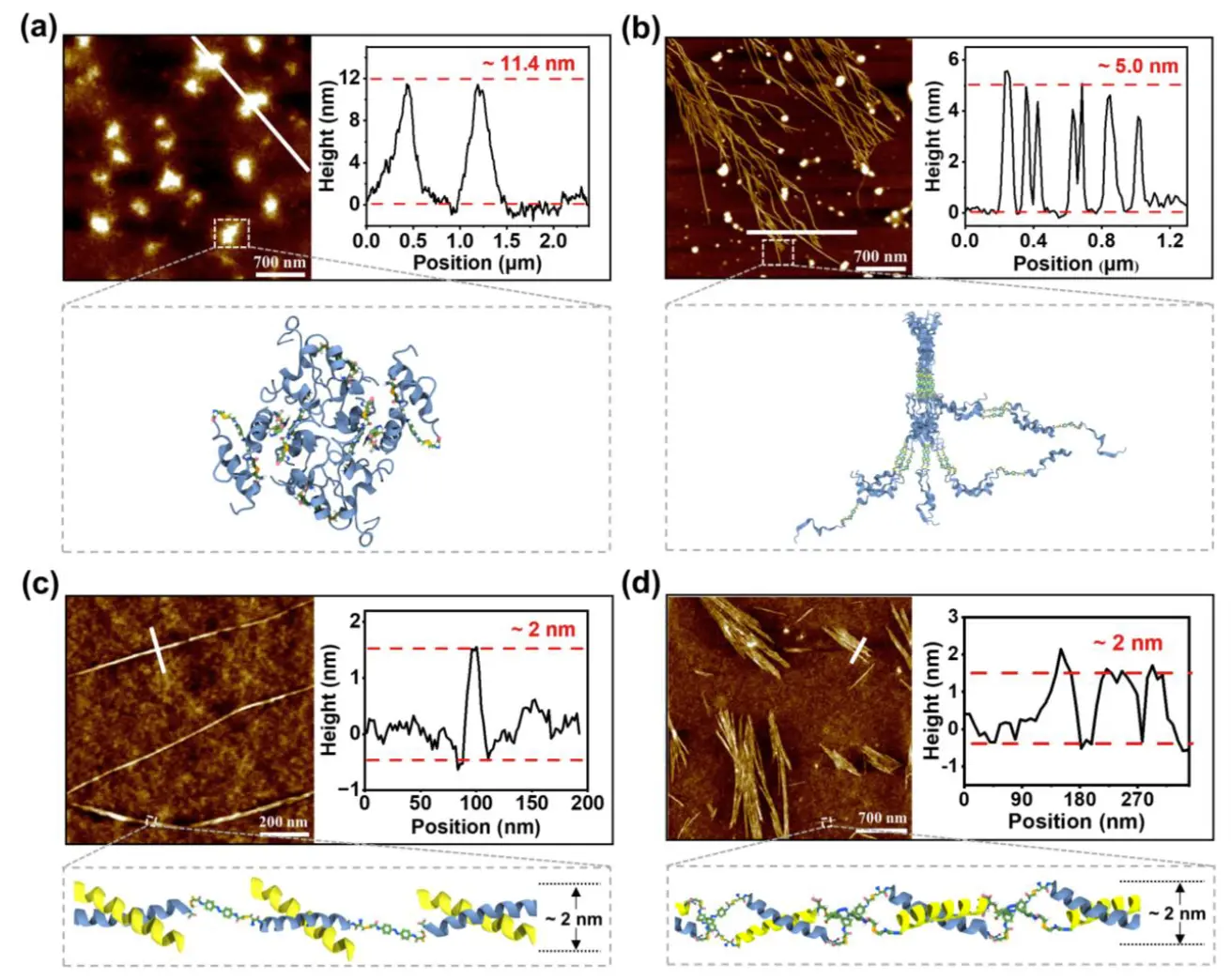
图 4. CoP(E3–AZO) 在不同环境中的自组装。 CoP(E3–AZO) 自组装的 AFM 图像(a)在 pH 为 4 时,(b)在 pH 为 10 时,(c)与 K3 分子,以及(d)与 CoP(K3-AZO) 共聚物。 AFM图像右侧的图显示了白线所在区域的高度分布。
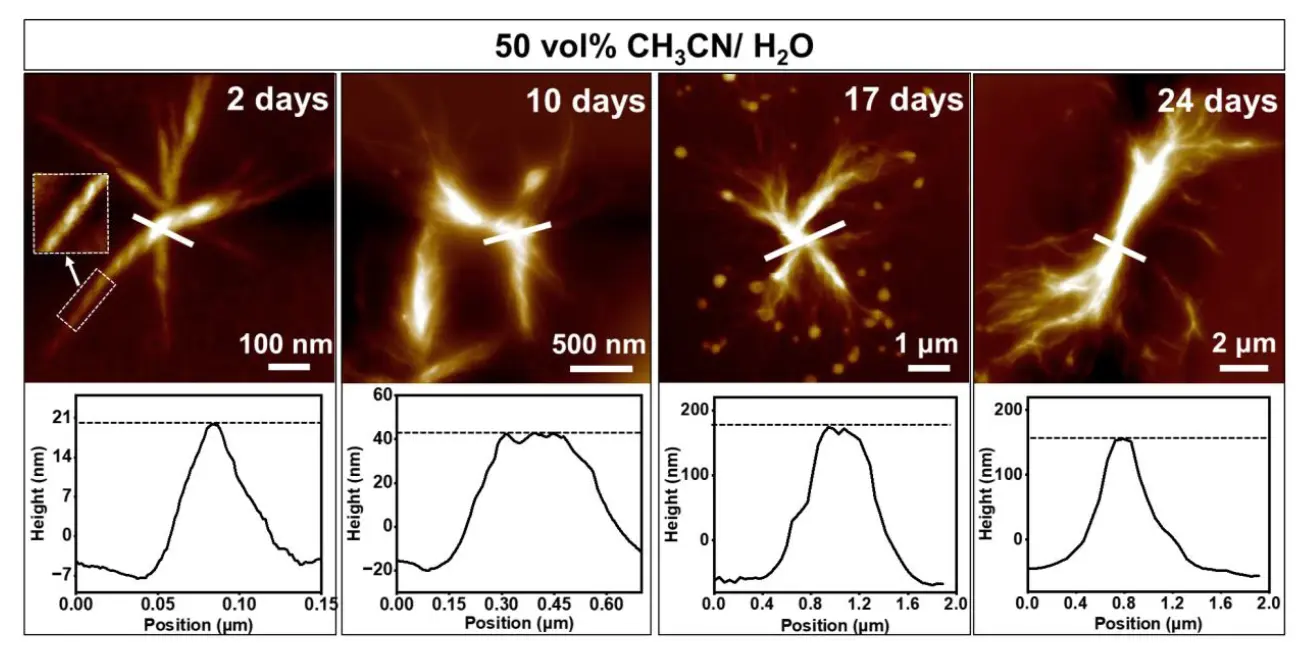
图 5.AFM 图像显示 CoP(E3-AZO) 在 50 vol% CH3CN/H2O 中自组装 2、10、17 和 24 天时的结构演化。 AFM 图像下方的图表显示了白线所在区域的高度剖面。
值得注意的是,这些超薄纳米片在特定浓度下能选择性地抑制癌细胞。
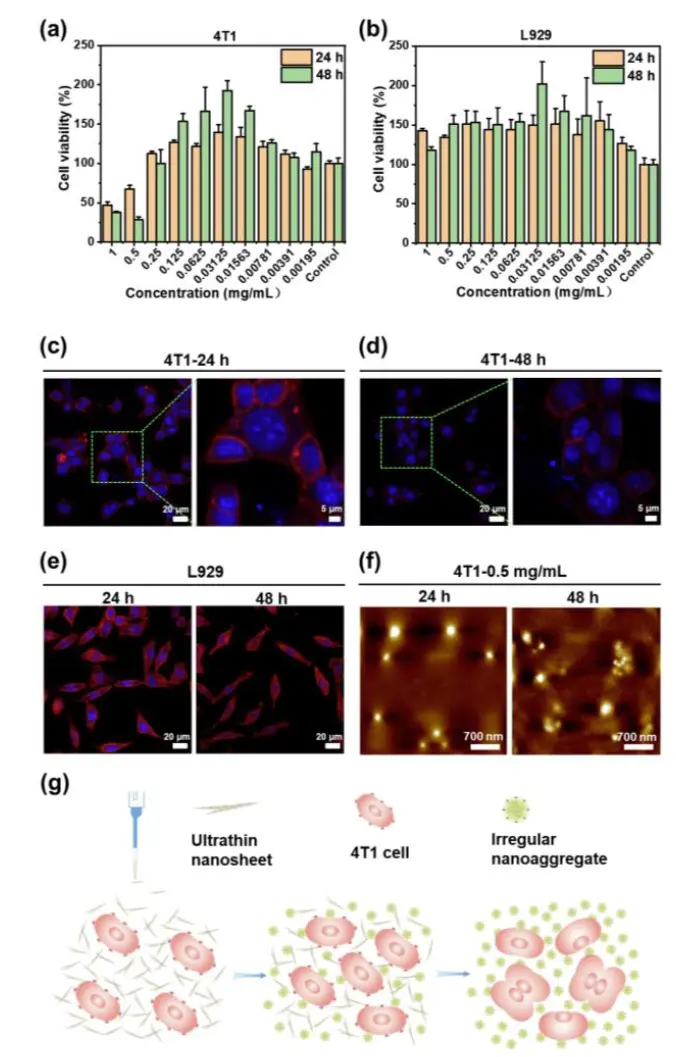
图6.超薄纳米片对4T1细胞的抗癌活性。 (a) 用不同浓度的超薄纳米片处理的 4T1 细胞的相对细胞活力 (n=3)。 误差线表示标准偏差。 (b) 用不同浓度的超薄纳米片处理的 L929 细胞的相对细胞活力 (n=3)。 误差线表示标准偏差。 (c) 用 1 mg/mL 超薄纳米片处理 24 小时的 4T1 细胞的细胞形态。 (d) 用 1 mg/mL 的超薄纳米片处理 48 小时的 4T1 细胞的细胞形态。 (e) 用 1 mg/mL 超薄纳米片处理 24 和 48 小时的 L929 细胞的细胞形态。 (f) 0.5 mg/mL 超薄纳米片与 4T1 细胞孵育 24 和 48 小时的 AFM 图像。 (g) 示意图显示 pH 响应性超薄纳米片抑制 4T1 细胞生长。
这项研究不仅丰富了2D纳米材料的家族,也为生物医学材料的开发提供了新的平台。超薄纳米片的智能响应特性,使其在传感、催化、电化学应用等领域具有巨大的应用潜力。特别是在生物医学领域,它们为癌症治疗提供了新的策略。
研究论文原文链接:https://doi.org/10.1002/anie.202405765




